IPTG诱导原理(原核表达)
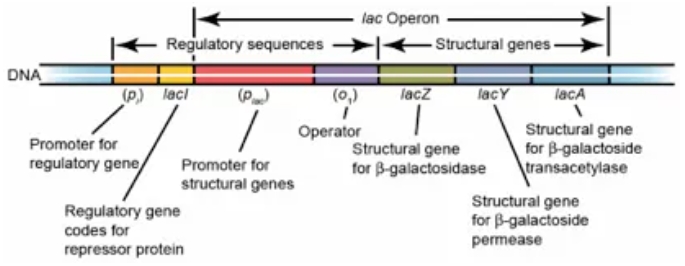
乳糖操纵子结构基因
IPTG诱导原理.
Lac阻遏物是一种具有4个相同亚基的四级结构蛋白,都有一个与诱导剂结合的位点。在没有乳糖存在时,lac操纵子(元)处于阻遏状态,Lac阻遏物(即下图中的阻遏蛋白)能与操纵基因O结合,阻碍RNA聚合酶与P序列结合,阻止了转录的路径,从而抑制转录启动。而当有诱导剂(这里指IPTG)存在时,诱导剂可与阻遏蛋白结合,使阻遏蛋白构象发生变化,导致阻遏物从操纵基因O上解离下来,RNA聚合酶不再受阻碍,启动子P开始发生转录,启动反应开始发生转录。
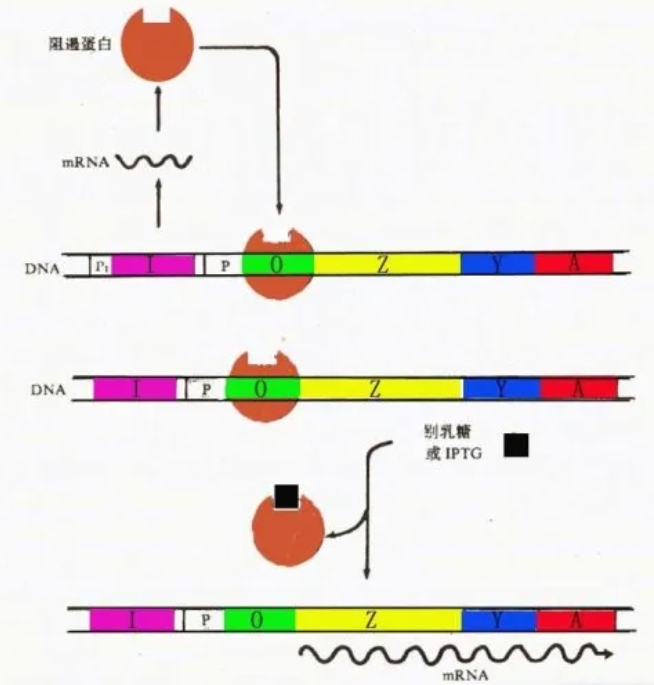 、
、IPTG诱导表达实验方法
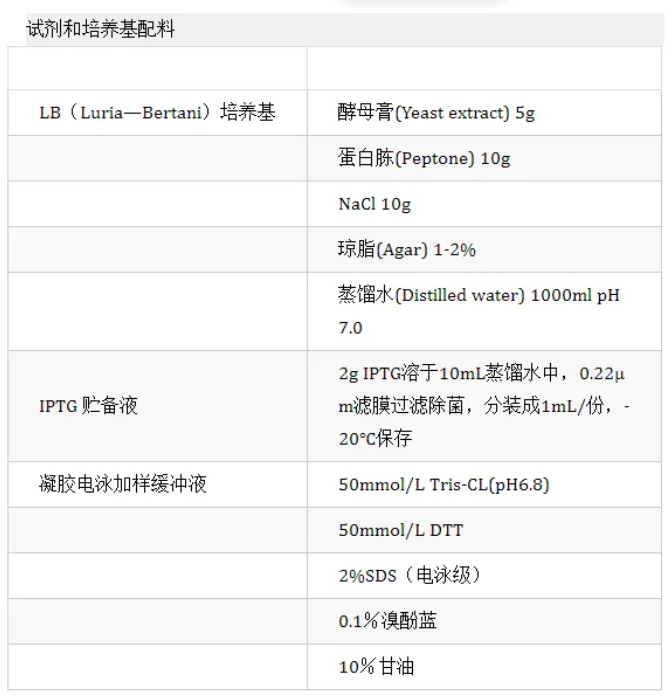
原核表达鉴定详细实验步骤
拿到质粒,离心(3000r/min;2min) 在质粒中加入TE【使质粒最终加入到110μL感受态细胞中的量为80-100ng,据此确定加入TE的量】,一般为(1μg质粒加20μLTE;2μg质粒加50μLTE;5μg质粒加100μL TE) 将质粒与TE混匀,吸取2μL混液与感受态细胞混匀 将感受态细胞放入冰箱(4℃)中,30min 取出后立即放入水浴锅中(42℃),热激90s, 再次放入冰箱(4℃)中,3min 拿出后取200μL的LB液体培养基加入到已转入质粒的感受态细胞中 放入摇床(37℃; 195r) 中, 30nim至60min; (最佳45min) 取出离心(3000r/min;2min) 去掉200μL的上清,留100μL左右上清悬浮沉淀,吸取50μL悬液涂平板,【先将对应抗性的平板放入培养箱(37℃)中预热20min】 把平板放入培养箱(37℃),过夜(12h至16h)
每个平板挑取单菌落至4支对应抗性的LB(4ml)试管中,编号为“0”“1”“2”“3” 将试管放入摇床(37℃;195r) 中,【单抗3h左右;双抗4h左右;刚开始用可见分光光度计测OD值;熟练后可目测(背光下,以试管中的枪头为例,刚刚看不见枪头即可)】,测OD值(0.6至0.8) 从“0”号管中取700μL悬液加入到100μL(C=80%)的保种甘油中,震匀,放入冰箱(-20℃)冻存 在每组菌的“1”“2”“3”号试管中分别加入2μL的IPTG【终浓度0.5mM最适,可根据日后表达摸索】 视不同的载体选择适合的表达环境【PET/PGEX:15℃表达过夜;25℃表达6h;37℃表达3h至4h(4支试管,“0”“1”号试管15℃表达过夜;“2”“3”试管37℃表达3h至4h)。Pcold:【全部15℃表达过夜】
3.表达鉴定第三天,全菌的表达鉴定分析,注意控制溶质的量及溶液黏度
从每组4支的试管中均取500μL菌液加入到1.5ml离心管中,【若OD值不一样,值小的可多取】离心(6000r/min),5min, 去上清,留沉淀【沉淀少的,可再取菌液离心,尽量使沉淀量接近】 在每个离心管中加入500μL的DDH2O,悬浮沉淀,离心(6000r/min),5min, 去上清,留沉淀 在每支离心管中加入45μL的1×PBS和45μL的2×Loading Buffer悬浮沉淀【当溶质适量且均一的情况下,加入量不变;当溶质多且粘稠时,应使加入量增大,为降低粘度也可减少上液量】 放入煮样器(100℃) 25min 取出后离心(6000r/min) 3min, 电泳检测。 蛋白表达量不错,进行蛋白纯化.蛋白表达量低或者没表达就菌株与质粒、诱导条件、目的蛋白特性、培养环境及检测环节五大类来进行排查分析。
科普文章均整理自网络,仅作知识分享,无商业用途。若有侵权,请联系后台,提供文章标题、链接等信息,我们核实后会立即删除,感谢理解。